Gene therapy
Gewisse Krankheiten könnten möglicherweise geheilt werden, wenn es gelänge, ein therapeutisches Gen in die Zellen des erkrankten Organs einzubringen. Bei der Genersatztherapie beispielsweise übernimmt dabei das therapeutische Gen die Rolle eines fehlerhaften Gens und stellt so die Funktionsfähigkeit des erkrankten Organs wieder her. Um das Therapie-Gen in die gewünschten Zellen einzubringen, werden ausgeklügelte Methoden benötigt. Als Transportvehikel – sogenannte Vektoren – für das Gen dienen veränderte Viren.
Soviel wie nötig und so wenig wie möglich
Um ein Virus in ein sicheres und wirksames Transportvehikel umzubauen, müssen zuerst alle Gene entfernt werden, die für die krank machenden Eigenschaften des Virus verantwortlich sind oder es diesem ermöglichen, sich in den Wirtszellen zu vermehren. In einem nächsten Schritt werden jene Gene zusammen getragen, die für die Herstellung der verschiedenen Bestandteile des Vektors nötig sind. Anschliessend wird der Vektor Zellkulturen (d.h.in Zellen in einem Nährmedium) produziert. Dazu werden den Zellen sowohl die Gene für die Herstellung des Vektors als auch das benötigte Therapie-Gen eingeschleust. Die Zellen produzieren alle Bestandteile des Vektors und verpacken darin das Therapie-Gen. Dass nur das Therapie-Gen eingepackt wird, liegt daran, dass ihm als einzigem Gen ein entsprechendes Verpackungssignal hinzugefügt wurde (siehe Abbildung).
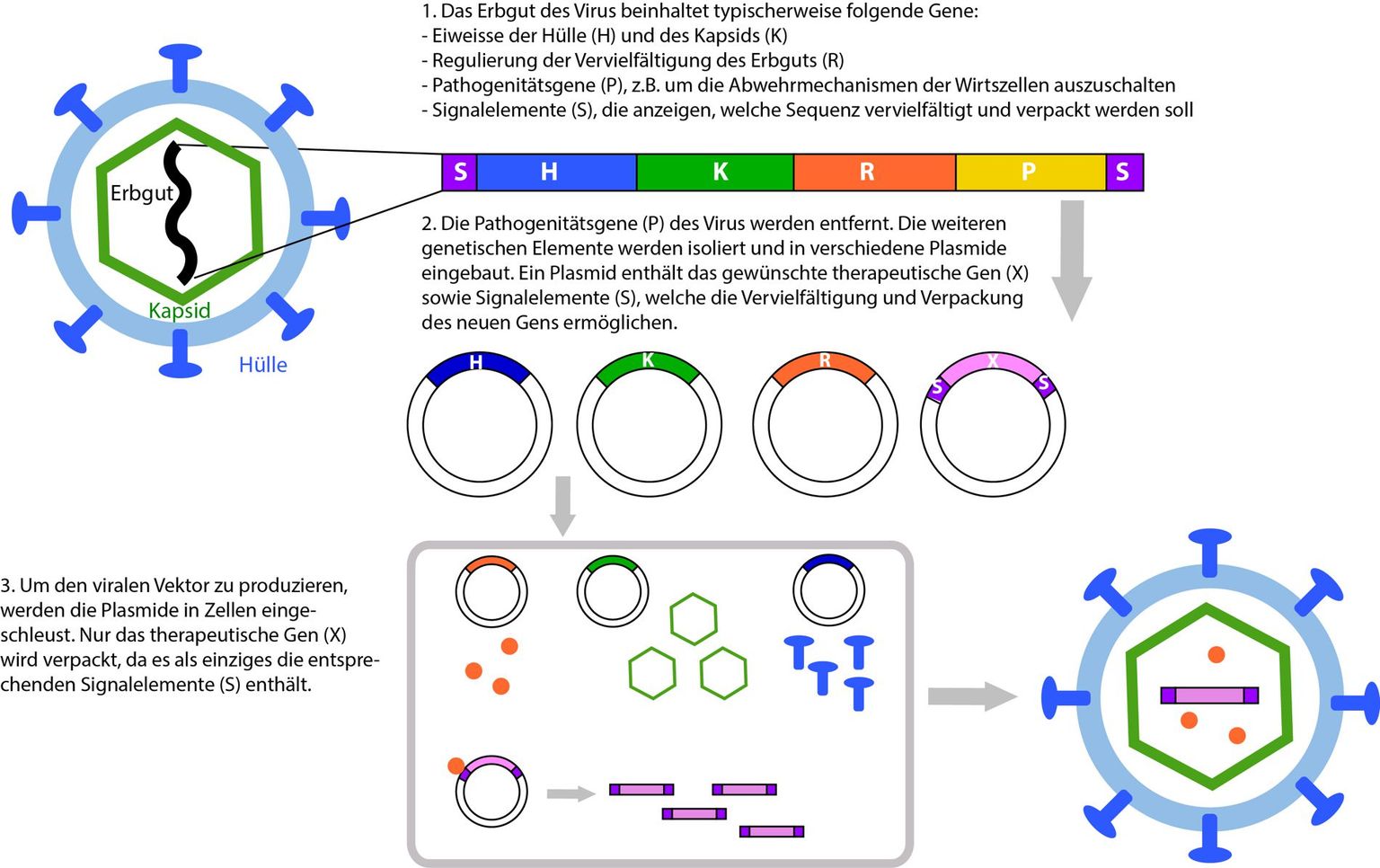
Dieses Verfahren zur Produktion von Vektoren stellt eine Vorstufe der Synthetischen Biologie dar. Als die ersten Vektoren erzeugt wurden, griff man ausschliesslich auf natürlich vorkommende Virussequenzen zurück. Dieser Ansatz liegt denn auch näher bei der herkömmlichen Biotechnologie als bei der Synthetischen Biologie.
Verbesserte Zielgenauigkeit künstlicher Vektoren
Die oben geschilderte Methode wurde in der Folge durch verschiedene Ansätze erweitert. Bei einer Gentherapie ist es entscheidend, dass der Vektor die erkrankten Zellen erkennt, sich daran bindet und das Therapie-Gen darin einschleust. Viren enthalten eine innere Hülle – das Kapsid – welches bestimmte Zelltypen anhand ihrer Membranstruktur erkennt und dem Virus ermöglicht, sich daran zu binden. Gewisse Viren besitzen zusätzlich eine äussere Hülle, welche das Kapsid umgibt. Um bei einer Gentherapie die richtigen Zellen erreichen zu können, muss also ein Kapsid (oder eine äussere Hülle) gewählt werden, das zu diesem Zelltyp passt. Dieses Kapsid kann entweder von einem anderen Virus stammen oder genetisch verändert oder gänzlich neu synthetisiert werden. Mit den letzteren Ansätzen ist es auch möglich, solche Zelltypen zu erreichen, die natürlicherweise von keinem bekannten Virus erkannt werden. Eine etwas andere Strategie besteht darin, der äusseren Hülle zusätzliche kleine Eiweisse oder Teile von Antikörpern beizufügen. Die zusätzlichen Eiweisse binden spezifische Moleküle an der Oberfläche der angesteuerten Zellen und ermöglichen es so dem Vektor, sich an diese zu binden.
Steuerbare therapeutische Gene
Das therapeutische Gen kann so entworfen werden, dass seine Aktivität kontrolliert werden kann, z.B. durch einen bestimmten Wirkstoff. Dazu wird dem Therapie-Gen eine passender regulierende DNA-Sequenz – ein sogenannter Promoter – vorgeschalten. Der Promoter wird so gewählt, dass er auf den gewünschten Wirkstoff reagiert und das Therapie-Gen entsprechend an- oder ausschaltet.1
Das Therapie-Gen schliesslich kann entweder vom Menschen oder von einem anderen Organismus stammen oder sogar künstlich hergestellt werden. Ein Gen aus einem nicht-menschlichen Organismus liegt beispielsweise dem jüngst entwickelten optogenetischen Ansatz zu Grunde, der darin besteht, eine Zelle mit einem Lichtimpuls zu aktivieren. Die dazu verwendeten lichtempfindlichen Eiweisse stammen ursprünglich aus Mikroorganismen und steuern dort die Bewegungen der Geisseln. Der optogenetische Ansatz könnte beispielsweise dazu benutzt werden, um bei Patienten, deren eigene Lichtrezeptoren im Auge nicht mehr funktionieren oder gar fehlen, das Sehvermögen wiederherzustellen.2 Bei vielen psychischen Krankheiten hingegen wird versucht, die Aktivität der Nervenzellen günstig zu verändern. Eine Möglichkeit dazu sind künstliche Ionenkanäle. Bereits vor mehr als drei Jahrzehnten wurden solche entworfen – heute kann man sie im Labor herstellen.3 Eine Kombination der oben beschriebenen Ansätze ist ebenfalls möglich. Somit ist zumindest grundsätzlich eine Therapiestrategie denkbar, bei der ein neu entworfenes synthetisches Therapie-Gen, das von einem synthetischen Promoter kontrolliert wird, mit Hilfe eines Vektors, der in der Natur nicht existiert, in das erkrankte Organ eingeschleust wird.
Neue zelluläre Stoffwechselwege entwickeln
Die oben angeführten Strategien wurden nochmals weiterentwickelt, indem Zell- und Gentransfer kombiniert werden, um eine verlorene Organfunktion wiederherzustellen. Die Forschungsgruppe von Martin Fussenegger an der ETH Zürich in Basel hat so eine Therapie zur Behandlung von Diabetes entwickelt – bisher allerdings nur für Mäuse.4 Bei Menschen mit Diabetes ist der Blutzuckerspiegel zu hoch. Dieser wird durch das Hormon Insulin kontrolliert, welches in der Bauchspeicheldrüse produziert wird. Bei Diabetes-Patienten ist die Wirkung des Insulins gestört. Für ihren Therapieansatz haben die Forschenden der ETH Zürich in einem ersten Schritt Zellen genetisch so verändert, dass sie einen bestimmten Wirkstoff unter der Kontrolle von Licht freisetzen. Um die Zellen lichtempfindlich zu machen, wurde ihnen das Gen für den Fotorezeptor Melanopsin eingeschleust. Parallel dazu erhielten die Zellen ebenfalls ein Gen für das Hormon GLP-1, das die Insulinproduktion in der Bauchspeicheldrüse anregt. Dem GLP-1 Gen wurde ein spezieller Promoter vorangestellt. Dieser stellt sicher, dass das Gen nur dann das GLP-1 Hormon produziert, wenn Licht auf die Melanopsin-Rezeptoren fällt (siehe Abbildung).
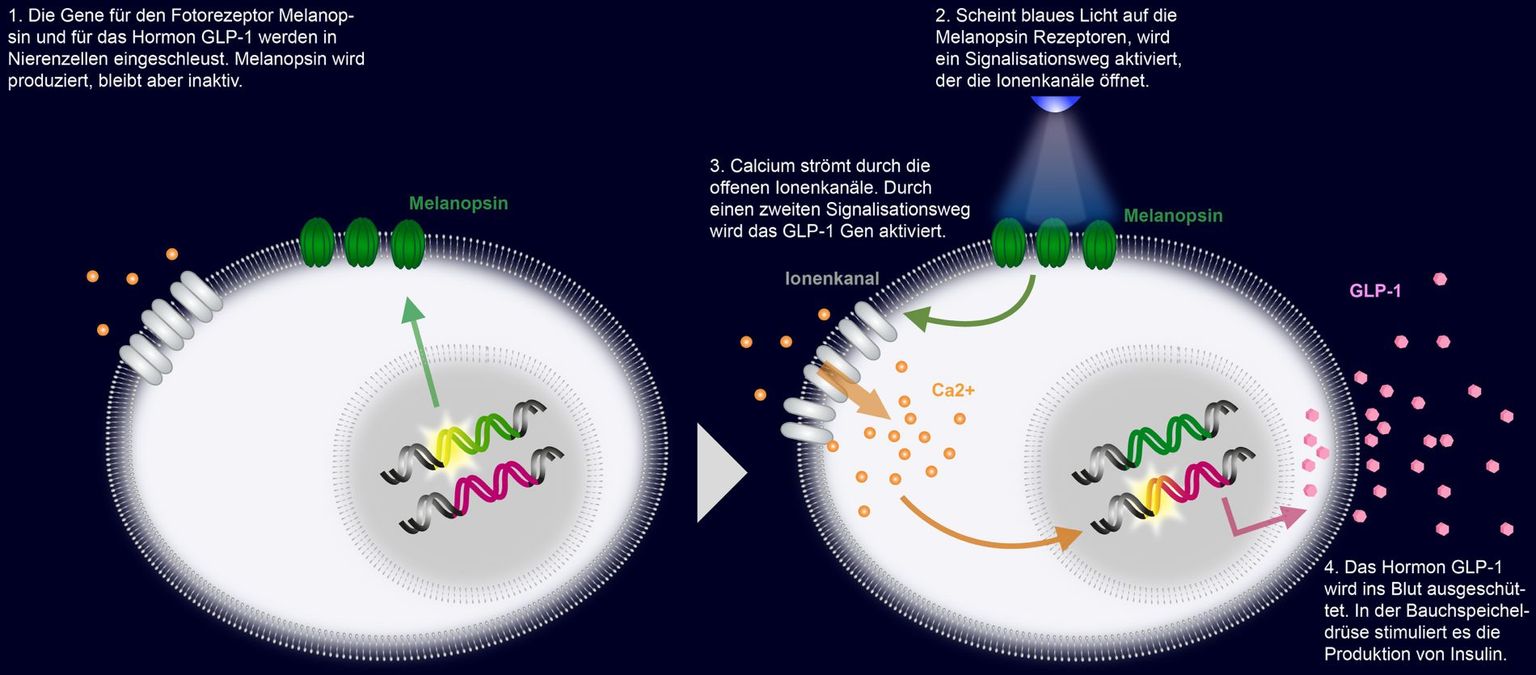
In einem zweiten Schritt wurden die mit dem Melanopsin-Gen und GLP-1-Gen ausgestatteten Zellen in Mikrokapseln verpackt und den an Diabetes erkrankten Mäusen unter die Haut transplantiert. Wurden die Mäuse anschliessend mit Licht bestrahlt, produzierten die transplantierten Zellen das Hormon GLP-1. Dieses regte die Insulinproduktion an und der Blutzuckerspiegel senkte sich. Dieses Beispiel zeigt, dass es mit Hilfe der Synthetischen Biologie möglich ist, zu therapeutischen Zwecken Zellen mit neuen Eigenschaften zu entwerfen und herzustellen.
Herausforderungen
Das Ziel einer Genersatz –Therapie ist es, ein fehlerhaftes Gen durch eine intakte Sequenz zu ersetzen und so eine verloren gegangene Funktion wiederherzustellen. Diese Therapie folgt somit einem ähnlichen Ansatz wie die Zell- oder Organtransplantation. Der optogenetische Ansatz enthält dagegen eine weitere Dimension: Nervenzellen werden mit neuen Fotorezeptoren ausgestattet und können somit durch äussere Stimuli angeregt und kontrolliert werden. Wenn der optogenetische Ansatz verwendet wird, um das Sehvermögen wieder herzustellen, ist er der Genersatztherapie sehr ähnlich, da die neuen therapeutischen Fotorezeptoren eine verloren gegangen natürliche Funktion des Auges ersetzen. Aber wenn diese Technik verwendet würde, um bestimmte Schaltkreise innerhalb des Gehirns zu kontrollieren – beispielsweise um einer epileptischen Aktivität5 oder einem krankhaften Verhalten6 entgegen zu wirken – entstände eine neue Art von Gehirnkontrolle, die bisher in dieser Form nicht möglich ist. Eine solche Anwendung könnte grosse gesellschaftliche Auswirkungen haben, ähnlich wie die Entwicklung von Antipsychotika in den 1960-er Jahren, aber mit dem neuen Potential, jegliche Art von Nervenzellen erreichen zu können. Solche Therapieansätze zur Kontrolle von Gehirnaktivitäten werden in naher Zukunft beim Menschen nicht eingesetzt werden. Aber dass sie grundsätzlich möglich sind, konnte bereits gezeigt werden. Deshalb ist es wichtig, bereits heute über solche mögliche Anwendungen und mögliche ethische Grenzen zu diskutieren, besonders mit Blick auf die medizinische Behandlung von psychischen Krankheiten.
Aktivitäten in der Schweiz:
Im Bereich der Gentherapie sind verschiedenste Forschungsgruppen in der Schweiz tätig. Zwei Beispiele:
Botond Roska, Friedrich Miescher Institut, Basel
Erforschung von neuralen Schaltkreisen mit Hilfe von molekularbiologischen und gentechnischen Methoden. Link
Martin Fussenegger, ETH Zürich
Entwicklung von medizinischen Therapieverfahren: von Biopharmaka über Gentherapien bis Gewebekonstruktion. Link
Referenzen
- Guo ZS et al. (2008) Gene transfer: the challenge of regulated gene expression. Trends in molecular medicine. 14: 410-418. Link
- Busskamp VS et al. (2012) Optogenetic therapy for retinitis pigmentosa. Gene Therapy 19: 169-175. Link
- Sakai N and Matile S (2013) Synthetic ion channels. Langmuir. 29: 9031-9040. Link
- Ye H et al. (2011) A synthetic optogenetic transcription device enhances blood-glucose homeostasis in mice. Science. 332: 1565-1568. Link
- Walker MC et al. (2013) Gene therapy in status epilepticus. Epilepsia. 54 (6): 43-45. Link
- Dias BG et al. (2013) Towards new approaches to disorders of fear and anxiety. Current opinion in neurobiology. 23: 346-352. Link


